胃肠道一直处于运动状态,其动力稳态与人体消化吸收、代谢免疫,甚至情绪调节等息息相关。肠道内容物的物理刺激是控制胃肠道运动的重要因素,其化学组分也可以通过肠上皮的相关受体调控胃肠运动,然而肠道内容物是否存在其它调节途径尚不清楚。陈鑫、朱敏生教授团队第一次提出肠神经元是消化道内长链脂肪酸的化学感受器,可以直接感知肠内LUFFAs并精确控制动力,这是一种不依赖于传统机械刺激和肠上皮介导的动力调控新模式。
本项研究首先测试了常见长链脂肪酸对于结肠收缩的影响,发现长链饱和脂肪酸和烯烃键少于3的长链不饱和脂肪酸(LUFFAs)不影响或轻微抑制结肠收缩,而烯烃键≥3的LUFFAs显著抑制结肠收缩,尤其是深海鱼油ω-3脂肪酸(OFAs)成员-二十碳五烯酸(EPA)、二十二碳五烯酸(DPA)和二十二碳六烯酸(DHA),抑制效果最好。通过在小鼠体内外,以及人肠道组织检测,确定EPA和DHA对于胃、小肠和结肠动力均有阻碍作用,而DPA仅针对结肠。免疫荧光实验证实,消化道中识别LUFFAs的受体FFAR1和FFAR4主要存在于肠硝基能神经元上,可能介导神经递质一氧化氮的释放。进一步,通过FFAR1/4稳定敲除细胞株以及肠硝基能神经元特异性标记GCaMP6s小鼠,发现EPA和DHA能够同时激活FFAR1和FFAR4双受体,而DPA主要激活FFAR4,因此DPA不能抑制肠神经元FFAR4敲除小鼠结肠运动。目前临床上缺少硝基能神经元激动剂,而硝基能神经元病变与诸多疾病相关(如腹泻、抑郁、贲门失弛症等),该研究成果提示LUFFAs可能用于该类疾病的临床干预。
慢性便秘是一种常见的肠道动力失衡疾病,约三分之一患者对常规疗法不敏感,严重者需要通过手术切除结肠缓解症状。本团队在前期研究中曾提出部分慢性便秘是由一类肠道细菌Shigella sp. PIB感染所致,该菌能够定殖于结肠黏膜,合成DPA抑制结肠收缩,导致患者肠传输减缓和便秘发生。使用针对PIB的噬菌体鸡尾酒制剂可以治愈PIB感染引起的慢性便秘(JCI, 2022)。基于该项研究展开的的PIB噬菌体制剂治疗慢性便秘临床试验目前正在太阳成城集团tyc234cc古天乐附属鼓楼医院进行。然而,DPA是如何调控肠道动力的当时尚不清楚。此项工作成功解决了这一疑问,即PIB定植于肠黏膜后产生的DPA通过肠硝基能神经元上的FFAR4受体升高胞内钙离子浓度,促使释放一氧化氮舒张平滑肌导致肠动力减缓和便秘发生(图1)。
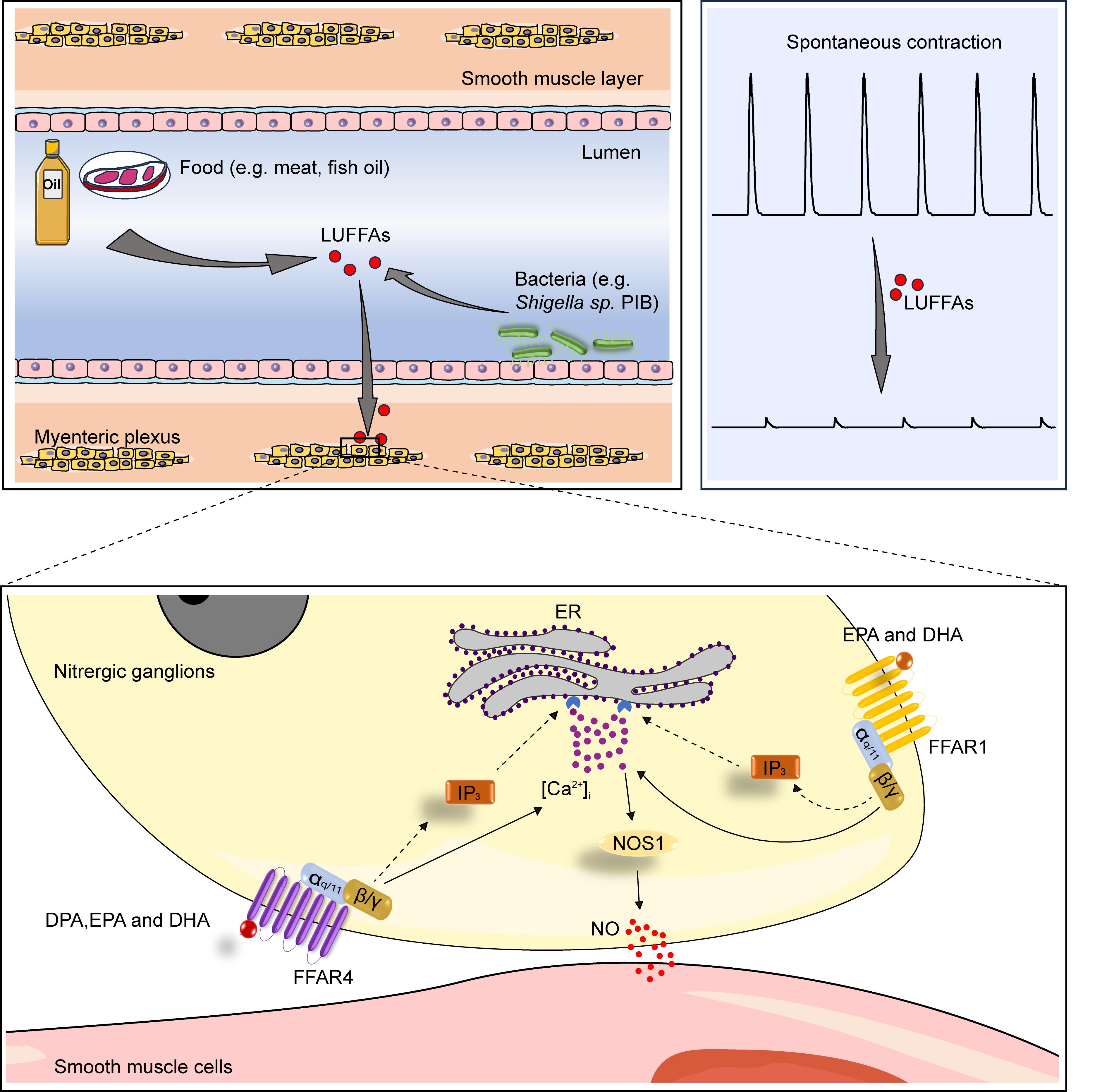
图1. 长链不饱和脂肪酸调控肠动力的机制
研究工作以“Long-chain unsaturated free fatty acids control gut motility via nitrergic ganglia of enteric nervous system”为题于2025年11月11日在学术期刊PNAS上发表。太阳成城集团tyc234cc古天乐博士张军浩、蒋志慧,附属金陵医院宣佶为本文共同第一作者,太阳成城集团tyc234cc古天乐陈鑫、朱敏生和南京师范老员工命科学公司陈华群教授为共同通讯作者,此项工作也得到来自南京医科大学、南京中医药大学和江南大学等单位研究者的支持,研究经费由国家自然科学基金、江苏省自然科学基金和国家重点研发计划提供。

关键词:长链不饱和脂肪酸,胃肠道动力,肠硝基能神经元,游离脂肪酸受体
原文链接:https://doi.org/10.1073/pnas.2513368122
